Актуальность. Термин «ДЭП (дисциркуляторная энцефалопатия)» является групповым понятием, объединяющим все патофизиологические механизмы хронической церебральной ишемии. Диагноз ДЭП необходимо уточнять указанием причинных нозологических форм кардиальной, васкулярной (в том числе «БМС»), гематологической или иной патологии для целенаправленной профилактики прогрессирования симптомов. БМС является условно составной частью ДЭП, но ее следует рассматривать отдельно ввиду наличия характерных критериев диагностики, отличий патогенеза и нерешенных вопросов профилактики.
Запомните! Поражение мелких сосудов считают одним из наиболее распространенных патоморфологических процессов в сосудистой неврологии. Оно ассоциировано со старением, с когнитивным снижением, удвоением риска деменции и трехкратным увеличением риска инсульта.
Обратите внимание! В настоящее время термины «хроническая ишемия мозга», «дисциркуляторная энцефалопатия» нуждаются в пересмотре и/или уточнении, так как в формировании этих состояний могут участвовать разные патогенетические механизмы. В настоящее время предложено объединить эти патогенетические варианты собирательным термином БМС.
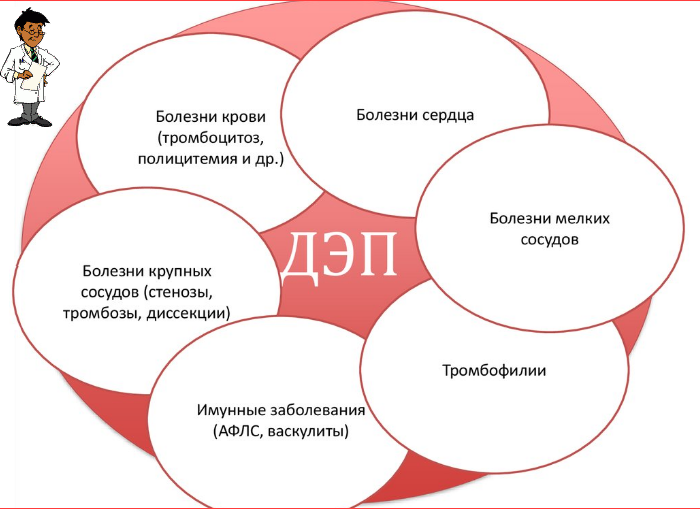
В настоящее время выделяют отдельную группу патологических состояний (из группы церебро-васкулярных болезней), которые получили название «болезнь мелких сосудов» — БМС ([!!!] поражение мелких сосудов является, в основном, системным расстройством, при котором страдают различные органы; однако в некоторых случаях головной мозг является основной мишенью такого поражения). Термин «БМС» используется для отражения клинических, радиологических или патологических явлений, приписываемых болезни мелких перфорирующих артерий и артериол, венул и капилляров, которые обеспечивают кровоснабжение глубоких структур головного мозга (ГМ).
Причинами развития БМС может быть артериолосклероз, амилоидная ангиопатия, наследственные или генетические заболевания мелких сосудов, поражения мелких сосудов, связанные с воспалением и иммунной патологией, коллагеноз вен и другие. Наиболее распространенной формой являются артериолосклероз или поражения, связанные с возрастом и сосудистыми формами риска.
Существуют различные типы поражения мелких сосудов. В группу БМС включают:
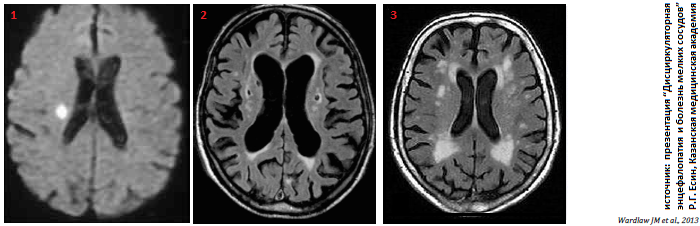
[1] лакунарный инфаркт (ЛИ) в большинстве случаев представляет собой небольшой, расположенный в глубинных отделах полушарий или в подкорковом белом веществе (но не в коре), мелкий инфаркт мозга от 3 мм до 20 мм в диаметре, выявляемый при компьютерной томографии (КТ) или магнитно-резонансной томографии (МРТ) и трансформирующийся в последующем в небольшую полость (лакуну — «завершенный инфаркт» — см. далее); часть таких очагов (т.е. ЛИ) может клинически сопровождаться острым очаговым дефицитом (лакунарный инсульт) — в этом случае речь идет о симптомных ЛИ мозга, которые составляют от 20 до 30 % всех подтипов ишемического инсульта (см. рис.1);читайте также статью: Лакунарный инсульт (на laesus-de-liro.livejournal.com) [читать] [2] лакуны — лакуна предположительно сосудистой этиологии, определяется как подкорковая круглая или овальная полость, заполненная жидкостью (сигнал идентичен цереброспинальной жидкости [ЦСЖ]), диаметром 3 — 15 мм, соответствующая области предыдущего острого мелкого подкоркового (лакунарного) инфаркта или кровоизлияния (см. далее) в бассейне одной перфорантной артерии (см. рис.2); [3] гиперинтенсивность белого вещества – ГИБВ или лейкоареоз (выявляется у 17% здоровых взрослых лиц старше 70 лет, также наблюдается у 2/3 больных деменцией и у 1/3 лиц с болезнью Альцгеймера); изменения белого вещества выглядят при МРТ в Т2-режимах в виде участков повышенной интенсивности, которые находятся вблизи или отдаленно от желудочков; чаще они локализуются в белом веществе лобной доли; такие диффузные области ослабления в белом веществе, которые обнаруживали при КТ, называли «лейкоареозис»; патоморфологические исследования белого вещества выявляют широкий диапазон изменений, которые включают бледность миелина, расширение периваскулярных пространств, инфаркты, глиоз, утрату аксонов; по мере сливания таких повреждений развивается полная утрата всего нервного волокна и появляется картина гиперинтенсивности при МРТ-исследованиях (см. рис.3); установлено, что наличие таких изменений сопровождается нарушением познавательных функций, походки, мочеиспускания, падениями, расстройствами настроения и др. (болезнь Бинсвангера);
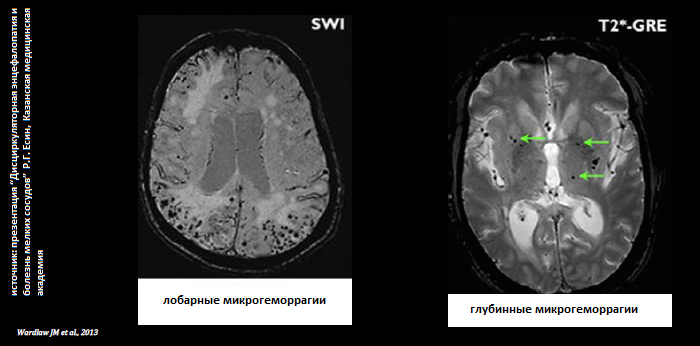
микрокровоизлияния (МК) — представляют собой гипоинтенсивные повреждения диаметром 2 — 5 мм, которые видны на МРТ Т2-взвешенных градиент эхо- (GRE) или чувствительно-взвешенных последовательностях (SWI); МК чаще всего локализуются в кортико-субкортикальном переходе, глубоких отделах серого или белого вещества полушарий, ствола мозга и мозжечка; предполагают, что МК соответствуют макрофагам, нагруженным гемосидерином в периваскулярной ткани вследствие диапедеза крови из сосуда (исходом МК могут быть лакуны — см. ранее); распространенность МК составляет 5% среди здоровых взрослых, 34 % — среди лиц, перенесших ишемический инсульт, и 60% — среди лиц после нетравматического внутримозгового кровоизлияния; клиническое значение МК связано с нарушением когнитивных функций;
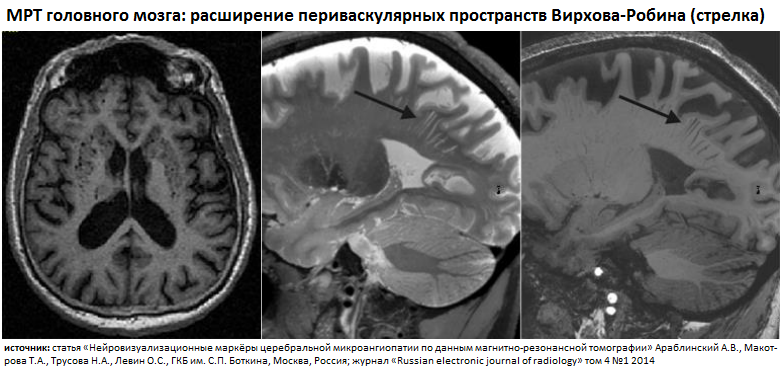
[5] расширение периваскулярных пространств Вирхова — Робена (криблюры) у людей пожилого возраста встречается часто; их часто ошибочно принимают за глубокие инфаркты (ЛИ) мозга; на самом деле это — заполненные ЦСЖ полости диаметром 2 мм, которые окружают мелкие проникающие артериолы; они могут возникать вследствие воспаления или нарушения целостности гематоэнцефалического барьера, накопления амилоида вдоль стенки сосуда, атрофии головного мозга (см. далее) и других причин;церебральная атрофия (в контексте БМС) – это уменьшение объема вещества ГМ, не связанное с макроскопическими фокальными повреждениями, такими как травма или инфаркты; потеря ткани замещается увеличением периферических (борозды) и центральных (желудочки) пространств СМЖ (заместительная гидроцефалия [наружная и внутренняя]); потери ткани в результате изолированного фокального повреждения, такого как кортикальные инфаркты, легче визуализировать в перекрестных проекциях и не следует путать с генерализованной глобальной или региональной атрофией, которая в свою очередь является вторичной по отношению к диффузному процессу.
БМС выявляется (! подтверждается) посредством, как правило, МРТ ГМ (нейрорадиологические маркеры): появление и широкое внедрение в клиническую практику новых методов нейровизуализации позволило по-новому оценить распространенность патологии мелких артерий и определить их роль в патогенезе развития мозгового инсульта и деменции; так, с помощью этих методов было установлено, что основными структурными проявлениями БМС являются [1] мелкие — лакунарные — глубокие инфаркты головного мозга, [2] ГИБВ головного мозга, [3] мозговые микрокровоизлияния, которые — 1, 2, 3 — (!!! обратите внимание) могут развиваться без явных клинических симптомов (например, «немые» инфаркты мозга).
Помимо нейрорадиологических маркеров в диагностике и прогнозе течения БМС, некоторые исследователи указывают на биохимические маркеры. Необходимо отметить, что в настоящее время клинические исследования в области биомаркеров находятся в стадии развития. Среди специфических биомаркеров наиболее значимыми являются нейрональные и глиальные маркеры. К первым относят глутамат, гомоцистеин, нейронспецифическую энолазу, тау-белок, N-ацетиласпартат, NR2-пептид, NR2-антитела и др. Глиальные маркеры включают белок S-100β, основной белок миелина, глиальный фибриллярный белок. Среди неспецифических маркеров у больных с БМС представляют интерес исследования концентрации противо-воспалительных цитокинов (IL-1β, TNF-α, IL-6, IL-10), благодаря их участию в механизмах апоптоза, и маркеров врожденного иммунитета и амилоидогенеза — β-амилоидных пептидов 1-40 (Аβ40) и 1-42 (Аβ42).
https://laesus-de-liro.livejournal.com/379283.html