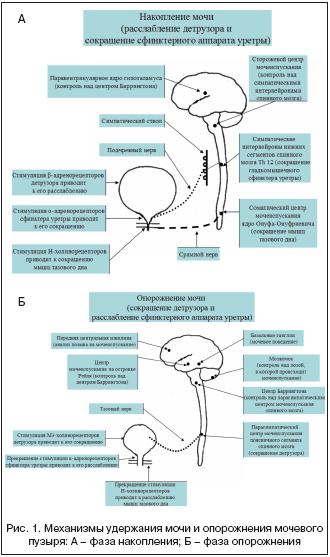
Акт мочеиспускания — координированный процесс, который состоит из двух синхронно связанных действий: сокращения детрузора и расслабления внутреннего и наружного сфинктеров мочевого пузыря. У больных, страдающих нейрогенной дисфункцией мочевого пузыря, вследствие поражения центральной или периферической-иннервации, нарушается координация процессов сокращения детрузора и расслабления сфинктеров.
Этиология
Нарушение функции мочевого пузыря чаще всего отмечается при опухолях спинного мозга, первичных или метастатических опухолях позвоночника, остеохондрозе позвоночника. Периферическая денервация мочевого пузыря и связанная с ней дисфункция его возникают в результате обширных оперативных вмешательств на органах таза и лучевой терапии.
Нейрогенная дисфункция мочевого пузыря наблюдается также при травме головного мозга, при нарушении мозгового кровообращения, когда возникает запредельное торможение центральной нервной системы; в результате аномалии развития концевых отделов спинного мозга (незаращение дужек поясничного и крестцового отделов позвоночника, спинномозговая грыжа, миелодисплазия); при болезни Паркинсона; инфекционных поражениях спинного Мозга (миелит, полиомиелит, менингит, энцефаломиелит, рассеянный склероз, сифилис и туберкулез нервной системы); при пернициозной анемии (фуникулярный миелоз); вследствие эндогенной или экзогенной интоксикации нервной системы, возникающей при диабете, болезни Аддисона; при различных отравлениях: препаратами мышьяка, солями тяжелых металлов, алкоголем; при длительном применении психофармакологических препаратов, а также при неправильном выполнении спинномозговой анестезии.
Причинами расстройства функций мочевого пузыря у детей, кроме перечисленных выше, являются врожденными заболевания спинного мозга, миелодисплазия и spina bifida. Проявляется это недержанием мочи и кала. Сразу же после нарушения иннервации заболевание протекает по типу «порочного круга»: первоначальная потеря функции мочевого пузыря приводит к изменению его анатомической структуры, а изменение структуры влечет за собой еще большие функциональные нарушения, которые в дальнейшем приводят к глубоким необратимым морфологическим изменениям нижних и верхних мочевых путей.
Патогенез
Нейрогенная дисфункция мочевого пузыря может проявиться или на уровне детрузора, в виде атонии или спастического состояния последнего, или же на уровне замыкательного аппарата сфинктеров, в виде либо задержки мочеиспускания, либо недержания мочи.
Характер нейрогенного расстройства мочеиспускания определяется не причиной, а уровнем и степенью поражения нервной регуляции акта мочеиспускания. Нарушения нейрорегуляции могут возникнуть на любом уровне цепи условного рефлекса мочеиспускания: головной мозг, проводящие пути, спинальный центр мочеиспускания (SII — SIV), периферические и интрамуральные нервные волокна и ганглии. При локализации повреждения в парацентраль- ных дольках и лобных долях головного мозга — корковых центрах мочеиспускания (нарушение кровообращения, травма, опухоль) развивается неконтролируемое мочеиспускание с отсутствием позывов на него. При полном поперечном повреждении спинного мозга выше спинальных центров мочеиспускания развивается рефлекторный тип расстройства мочеиспускания, что проявляется отсутствием позывов и рефлекторными сокращениями мочевого пузыря в ответ на растяжение его стенок накапливающейся мочой. Оба эти вида нарушения мочеиспускания объясняются выпадением коркового звена условного рефлекса мочеиспускания, которое становится безусловно рефлекторным. При тотальном повреждении спинальных центров мочеиспускания (SII—SIV) или экстрамедуллярных нервных стволов и ганглиев развивается автономный мочевой пузырь, практически неспособный к самостоятельным сокращениям, так как нарушается цепь безусловного рефлекса.
Описанные выше виды нейрогенных расстройств мочеиспускания являются крайними формами. В клинической практике гораздо чаще встречается большое количество переходных вариантов.
Воспалительный процесс в мочевом пузыре развивается на фоне нарушенной трофики и поэтому носит резко выраженный характер с прогрессирующим возникновением язвенных изменений. В этих условиях может развиться гнойно-воспалительный процесс, распространяющийся на толщу стенок мочевого пузыря и окружающие ткани. Хронический воспалительный процесс, постепенное замещение мышц детрузора соединительной тканью и нейротрофические изменения вызывают резкое нарушение замыкательной способности устьев мочеточников, вследствие чего появляются пузырно-мочеточниково-лоханочные рефлюксы, приводящие в свою очередь к стремительно нарастающему гидроуретеронефрозу.
Наступает резкое угнетение функциональной способности почек. Двухактное мочеиспускание, когда моча вначале поступает ретроградно в мочеточники и лоханки почек и лишь затем небольшими порциями выделяется наружу, приводит к грубым морфологическим изменениям мочевого пузыря и уменьшению его вместимости, в то время как дилатация верхних мочевых путей прогрессирует. Иногда в таких случаях при катетеризации мочевого пузыря выводят около 1,5—2 л застойной мочи. Это наводит на мысль об атонии мочевого пузыря, в то время как вместимость его в действительности равна 80—100 мл, а большое количество мочи поступает из резко расширенных верхних мочевых путей.
Симптоматика и клиническое течение
В зависимости от локализации повреждения нервной системы разнообразен и характер поражения функции мочевого пузыря. Различают следующие виды «нейрогенного» мочевого пузыря: рефлекторный, гипорефлекторный, гиперрефлекторный, арефлек- торный, склеротический.
Для рефлекторного мочевого пузыря характерен нормальный его объем при пониженном, нормальном или повышенном тонусе детрузора. Опорожнение мочевого пузыря может быть полным или частичным. Данная форма наблюдается чаще всего при высоких и не очень тяжелых повреждениях спинного мозга.
При гипорефлекторном мочевом пузыре рефлекс на мочеиспускание возникает при наполнении мочевого пузыря, значительно превышающем нормальное. В этом случае тонус мочевого пузыря может быть различным, но объем остаточной мочи всегда значителен. Данная форма наблюдается при повреждении среднесакральных сегментов спинного мозга. Внутрипузырное давление низкое, сила детрузора незначительная, рефлекс на мочеиспускание заторможен. Максимальное опорожнение мочевого пузыря возможно при дополнительном давлении на переднюю брюшную стенку над лобком. Шейка мочевого пузыря ригидна. Благодаря’ наличию чувствительной иннервации и барорецепторам иногда сохраняется ощущение наполнения мочевого пузыря, но чаще всего оно или ослаблено, или совсем отсутствует. За счет этого количество остаточной мочи и растяжение мочевого пузыря нарастает, что в значительной степени усугубляет атрофический процесс, идущий в детрузоре.
Для гиперрефлекторного мочевого пузыря характерен рефлекс на мочеиспускание при небольшом его наполнении (менее 200 мл). Тонус детрузора может быть различным, остаточная моча может присутствовать или отсутствовать. Эта форма нейрогенной дисфункции мочевого пузыря чаще всего возникает при повреждении спинного мозга в шейном и грудном отделах. Поражение сакральных сегментов спинного мозга приводит к возникновению незаторможенного спинального рефлекса на мочеиспускание.
Чувствительность мочевого пузыря ослаблена или потеряна. Иногда вследствие внезапного подъема внутрибрюшного давления наступает непроизвольное опорожнение мочевого пузыря. Спонтанное сокращение детрузора может наблюдаться также при перкуссии гипогастральной области или раздражении бедер. Отсутствие остаточной мочи при гиперрефлекторном мочевом пузыре наблюдается в тех случаях, когда очаг поражения находится выше отхождения чревных нервов.
В острой фазе спинального шока возникает арефлекторный мочевой пузырь, когда в результате отсутствия рефлекса на мочеиспускание возникает полная его задержка. Опорожнение мочевого пузыря может возобновиться только при восстановлении рефлекса на мочеиспускание.
Склеротический мочевой пузырь представляет собой тяжелую и необратимую форму поражения, чаще всего являющуюся исходом длительного перерастяжения, воспалительных и дегенеративных изменений мочевого пузыря при нейрогенной его дисфункции. При этой форме вместимость мочевого пузыря незначительна, эластичность стенок потеряна, рефлекс на мочеиспускание отсутствует.
Таким образом, основными клиническими проявлениями нейрогенной дисфункции мочевого пузыря являются нарушения мочеиспускания. Это выражается в задержке мочеиспускания, парадоксальной ишурии при переполнении мочевого пузыря или непроизвольном мочеиспускании.
При осмотре больных с арефлекторным и гипорефлекторным мочевым пузырем и перкуссии определяют перерастянутый мочевой пузырь. Вместимость его иногда может достигать 1—2 л. Присоединившаяся инфекция приводит к циститу, пиелонефриту, уросепсису. Частым осложнением является мочекаменная болезнь, вызванная нарушением уродинамики и хроническим (воспалением мочевых путей. Переполнение мочевого пузыря и окклюзия верхних мочевых путей камнями обычно не вызывают у больных с поражением спинного мозга (так называемых спинальных больных) субъективных ощущений в связи с нарушением чувствительности, что затрудняет распознавание этих осложнений. Такая стертая клиническая картина диктует необходимость тщательного урологического обследования у них не только нижних, но и верхних мочевых путей.
Диагностика
Первоначальное представление о степени и форме нейрогенной дисфункции мочевого пузыря можно составить по тщательно собранному анамнезу. На первом этапе обследования особенно важно установить точное время травмы позвоночника и спинного мозга, а также уровень поражения центральной или периферической иннервации. Внимательный опрос больных позволяет проследить переход одной формы нейрогенной дисфункции мочевого пузыря в другую и помогает определить тот метод лечения, который
необходим в период наблюдения. Данные лаборатории* шгигжшй ний позволяют судить о функциональной способности почек, результаты неврологического обследования — об уровне и глубине поражения центральной и периферической иннервации. Затем применяют рентгенологические, радиоизотопные и инструментальные методы исследования.
Обзорная рентгенография дает информацию о состоянии костном системы и наличии теней, подозрительных на конкременты мочевых путей. В связи с отсутствием болей в области почек и мочевого пузыря у «спинальных» больных для своевременного выявления мочекаменной болезни обзорную рентгенографию необходимо выполнять один раз в полгода. Экскреторная урография позволяет выявить функциональную способность почек, анатомо-функциональное состояние мочевых путей и их отношение к теням, подозрительным на конкременты. При невозможности выполнить ее необходимо воспользоваться изотопной ренографией или динамической сцинтиграфией. С помощью изотопных методов можно также определить количество остаточной мочи.
Для изучения состояния детрузора и замыкательного аппарата мочевого пузыря применяют цистоманометрию при заполнении мочевого пузыря и определение профиля внутриуретрального давления. Цистоманометрия является единственным методом, который позволяет определить вид нейрогенного расстройства мочеиспускания — рефлекторный, гипо-, гиперрефлекторный. Сочетая цистоманометрию с цистографией, можно выявить пузырномочеточниковые рефлюксы.
Существенную роль в оценке сократительной способности детрузора и внутриуретрального сопротивления играет измерение объемной скорости потока мочи (урофлоуметрия). При нейрогенных расстройствах мочеиспускания она, как правило, значительно снижена. Определение профиля внутриуретрального давления позволяет выявить несогласованность функций детрузора и наружного сфинктера, гипертонию последнего, что определяет тактику оперативного лечения.
Цистография или рентгенотелевидение позволяет при медленном введении определенного объема рентгеноконтрастного вещества в полость мочевого пузыря наиболее точно определить его истинную вместимость и способствуют раннему выявлению пассивных и активных пузырно-мочеточниково-лоханочных рефлюксов.
Проводимая параллельно электроиистометрия дает ценную информацию о состоянии сократительной способности детрузора.
Существенную роль в оценке сократительной способности детрузора и сопротивления уретры играет измерение скорости потока мочи с помощью урофлоуметра. При нейрогенной дисфункции мочевого пузыря она, как правило, значительно снижена. С целью выявления сократительной способности детрузора можно применять трансректальную стимуляцию мочевого пузыря: при сохраненной возбудимости детрузора в ответ на электрическое раздражение происходит подъем внутрипузырного давления.
При цистоскопии определяют количество остаточной мочи, вместимость мочевого пузыря, состояние его слизистой оболочки и мышечной стенки (по трабекулярности), исключают сопутствующее поражение (опухоль).
Дифференциальная диагностика
Дифференциальную диагностику необходимо проводить с заболеваниями, которые могут привести к атонии мочевого пузыря: аденомой и раком предстательной железы, склерозом шейки мочевого пузыря (болезнь Мариона), стриктурой мочеиспускательного канала, опухолью мочевого пузыря, локализующейся в области его шейки. Тщательно собранный анамнез, рентгенологические, цистоскопические, цистометрические и урофлоуметрические данные позволяют отдифференцировать нейрогенную дисфункцию мочевого пузыря от перечисленных заболеваний.
Основная цель лечения больных с нейрогенной дисфункцией мочевого пузыря состоит в создании .надежной эвакуации мочи из него, сохранении достаточной его вместимости, воздействии на воспалительный процесс и профилактике камнеобразования. В случае задержки мочеиспускания в первые 5—6 дней возможно опорожнение мочевого пузыря при помощи бимануального давления на мочевой пузырь: спереди на надлобковую область и сзади через прямую кишку. Однако после появления мочевой инфекции метод бимануального выдавливания мочи противопоказан и более целесообразна катетеризация мочевого пузыря. Периодическая (2—3 раза в сутки) катетеризация мочевого пузыря требует самого строжайшего соблюдения асептики, применения тонких эластичных катетеров из пластических материалов.
С целью ритмичной эвакуации мочи и промывания мочевого пузыря антисептическим раствором можно использовать постоянный катетер в сочетании с системой Монро. Особенности ее устройства состоят в следующем. Капельница имеет боковой отвод, на который надевают резиновую трубку с иглой (воздушный вентиль), а трубу, идущую от катетера к мочеприемнику, не опускают фазу вниз, а средней ее частью (куда вставляют дугообразную стеклянную трубку) укрепляют на штативе выше уровня мочевого пузыря. После налаживания системы по описанной схеме жидкость пускают со скоростью 60 капель в минуту, и она поступает в мочевой пузырь как в наиболее низко расположенный участок всей системы. Когда мочевой пузырь растягивается до физиологической вместимости, жидкость начинает наполнять трубку, ведущую к мочеприемнику. Как только жидкость минует дугообразную стеклянную трубку и достигнет уровня мочевого пузыря, по принципу сифона происходит быстрое и полное опорожнение мочевого пузыря.
После эвакуации жидкости происходит заполнение системы воздухом, который попал в мочевой пузырь вместе с каплями жидкости (благодаря наличию воздушного вентиля), и выделение его из пузыря вслед за жидким его содержимым. Тотчас по опорожнении мочевой пузырь начинает вновь постепенно наполняться жидкостью и весь цикл автоматически повторяется.
Достоинство данной системы состоит в том, что она постоянно капельно наполняет мочевой пузырь и струйно опорожняет его при определенном наполнении и внутрипузырном давлении в условиях, которые наиболее приближены к физиологическим, предупреждает сморщивание мочевого пузыря и способствует профилактике или ликвидации мочевой инфекции. Установление эпицистомического дренажа в первый же день задержки мочеиспускания показано только в том случае, если повреждение спинного мозга сопровождается травмой мочевого пузыря или мочеиспускательного канала.
Наличие эпицистомы увеличивает опасность появления каллезного свища, который трудно заживить в последующем, снижает возможность восстановления функций мочевого пузыря (из-за спавшегося состояния, неподвижности и склерозирования его) и вызывает пузырно-мочеточниково-лоханочные рефлюксы.
После эпицистостомии, необходимо осуществлять борьбу с инфекцией путем соблюдения асептики, перорального приема большого количества жидкости, антибактериальных препаратов (в соответствии с показателями антибиограммы), обеспечения достаточного диуреза, предупреждения пролежней. Необходимо также проводить активную физиотерапию, лечебную физкультуру. Основная задача указанных методов лечения состоит в сохранении резервуарной способности мочевого пузыря до того момента, когда становится возможным применение патогенетически обоснованных методов лечения и восстановления активного мочеиспускания. К последним относятся реиннервация мочевого пузыря путем энтеровезикопексии, трансректальная электростимуляция мочевого пузыря и радиочастотная стимуляция мочевого пузыря.
Реиннервация мочевого пузыря возможна с помощью выключенного и демукозированного сегмента тонкой кишки. Восстановление мочеиспускания иногда достигается трансректальной электростимуляцией мочевого пузыря.
Радиочастотную стимуляцию мочевого пузыря осуществляют с помощью внешнего генератора тока высокой частоты и имплантированного под апоневроз прямой мышцы живота приемного устройства с платиновыми электродами, фиксированными к детрузору. В последнем высокая частота преобразуется в низкую, наиболее физиологичную, вызывающую раздражение мышечной стенки мочевого пузыря и ее сокращение.
Техника операции. Для имплантации приемного устройства используют нижний срединный разрез с выделением мочевого пузыря и фиксацией на нем электродов. Отделив апоневроз от прямой мышцы живота слева или справа с целью подготовки места для приемного устройства, тупым путем расслаивают прямую мышцу живота и в образованный тоннель протягивают приемное устройство. Фиксацию приемного устройства производят на прямой мышце живота, которую затем зашивают кетгутовыми швами по типу дубликатуры. После этого послойно ушивают рану вокруг дренажей, установленных в паравезикальное пространство. Длительность пребывания последних зависит от травматичности операции, количества поступаемого раневого отделения и обычно колеблется в пределах 4— 6 дней.
Учитывая, что у больного отсутствует самостоятельное мочеиспускание, в послеоперационном периоде необходимо тщательно следить за опорожнением мочевого пузыря. Это достигается либо периодической катетеризацией (2—3 раза в сутки), либо дренированием мочевого пузыря посредством постоянного катетера на 8—12 дней. После заживления раны приступают к радиочастотной стимуляции со следующими электрическими параметрами: напряжение 10—15 Вт, частота 20 Гц, длительность импульса 6 м/с. Стимуляцию проводят 3—4 раза в день по 30 с, что позволяет восстановить активный процесс мочеиспускания.
В результате радиочастотной стимуляции мочевого пузыря и восстановления мочеиспускания удается значительно уменьшить воспалительные явления в мочевых путях, прогрессирование почечной недостаточности и предотвратить пузырно-мочеточниковый рефлюкс.
Иногда при большом сопротивлении сфинктеров, выявленном при сфинктерометрии и на основании данных уретрального профиля, с целью восстановления самостоятельного мочеиспускания можно произвести трансуретральную сфинктеротомию или трансуретральную резекцию шейки мочевого пузыря, которая в сочетании с радиочастотной стимуляцией дает положительные результаты.
Прогноз
Прогноз зависит от формы и стадии заболевания, от своевременности и правильности выбора патогенетически обоснованного лечения нейрогенной дисфункции мочевого пузыря.
https://www.medpuls.net/guide/urology/neyrogennye-rasstroystva-mocheispuskaniya-neyrogennaya-disfunkciya-mochevogo-puzyrya
ДИАГНОСТИКА НЕЙРОГЕННЫХ НАРУШЕНИЙ МОЧЕИСПУСКАНИЯ
Шварц П.Г.
Введение
Нейрогенные нарушения мочеиспускания являются типичным проявлением большинства неврологических заболеваний и наблюдаются у 10–90% больных в зависимости от характера и распространенности поражения нервной системы [1,3,7,10,15]. Эти расстройства носят функциональный характер и являются отражением процессов, происходящих в нервной системе (преимущественно в ее центральном отделе). Для каждого конкретного неврологического заболевания характерны индивидуальные симптомокомплексы и отличительные патогенетические механизмы, их формирующие [6]. Причины формирования стойких патологических рефлексов мочеиспускания заключаются в поражении центров мочеиспускания (ишемический инсульт, опухоли головного и спинного мозга), нарушении проведения нервных импульсов от рецепторов мочевого пузыря и уретры к корковым, подкорковым, стволовым или спинальным центрам мочеиспускания (рассеянный склероз, субкортикальная артериосклеротическая энцефалопатия), дегенеративных изменениях нервной системы и дисбалансе нейромедиаторов (болезнь Паркинсона, мультисистемная атрофия) [11,13,16].
Нейрогенные расстройства мочеиспускания могут быть первыми проявлениями заболевания (дисциркуляторная энцефалопатия) или присоединяться на поздних стадиях болезни (болезнь Паркинсона, болезнь Альцгеймера). В некоторых случаях симптомы нижних мочевых путей (СНМП) развиваются в первые сутки заболевания и постепенно регрессируют (ишемический инсульт, синдром Гийена–Барре), в других – указывают на обострение основного заболевания (рассеянный склероз ремиттирующего течения) [19].
Прогноз дальнейшего развития дисфункций мочевого пузыря, как правило, зависит от течения основного неврологического заболевания и в большинстве случаев неблагоприятный. Исключением можно считать постинсультные нарушения мочеиспускания при возобновлении нормального его ритма в течение восстановительного периода, что обусловлено реорганизацией центров мочеиспускания, и синдром Гийена–Барре при успешной ремиелинизации периферических нервных волокон (рис. 1). Нарастание симптоматики мочепузырных дисфункций возможно даже при уменьшении неврологического дефицита на фоне лечения основного заболевания (например, неполная ремиссия рассеянного склероза).
Эти и некоторые другие особенности течения нейрогенных расстройств мочеиспускания могут вводить в заблуждение даже опытных клиницистов, приводя к неоправданным оперативным вмешательствам (гиперактивный мочевой пузырь при наличии бессимптомной доброкачественной гиперплазии простаты), лечению «простатита» у молодых пациентов, страдающих рассеянным склерозом, и т.д.
В этой связи необходимо отметить, что только раннее выявление симптомов нарушения мочеиспускания, а также их своевременная фармакологическая коррекция позволяют восстановить нарастающий дефицит функций нижних мочевых путей (НМП).
Диагностика нейрогенных
нарушений мочеиспускания
Диагностические мероприятия, связанные с ранним выявлением нейрогенных нарушений мочеиспускания, сводятся к следующим:
• определение симптомов нарушения мочеиспускания (качественная и количественная оценка);
• установление четкой связи урологических симптомов с неврологическим заболеванием (временные факторы, сравнение клинических проявлений с данными параклинических исследований);
• выявление причины нарушения НМП (демиелинизация, ишемия, нейродегенерация);
• определение формы нарушения мочеиспускания (уродинамические исследования);
• определение функциональных и нейромедиаторных особенностей расстройства мочеиспускания (соматосенсорные вызванные потенциалы, методы нейровизуализации и фармако–аналитические исследования).
Определение симптомов нарушения мочеиспускания (качественная и количественная оценка). Для оценки степени характера и степени выраженности симптомов используют специально разработанные шкалы IPSS, LISS, Medsen–Iversen, Боярского и другие [4,14]. Данные шкалы, выявляющие ирритативные и обструктивные СНМП, были разработаны для урологических больных и, несмотря на их информативность, не до конца отвечают требованиям диагностики нейрогенных нарушений мочеиспускания. В случае нейрогенных нарушений мочеиспускания целесообразнее разделять симптомы нарушения чувствительной и двигательной сферы мочевого пузыря и уретры, дизритмические и поведенческие симптомы, а также связанные с положением тела больного (например, в случае нарушения ходьбы или постельного режима, когда больной вынужден мочиться лежа). Ниже приводим список основных симптомов, выявляемых у неврологических больных.
Симптомы нижних мочевых путей:
Ритм мочеиспускания:
□ норма (5–8), □ поллакиурия до____раз,
□ ноктурия до____раз.
Симптомы нарушения чувствительности:
□ позыв на мочеиспускание сохранен,
□ интенсивность позыва на мочеиспускание снижена,
□ позыв на мочеиспускание отсутствует,
□ позыв на мочеиспускание носит императивный характер,
□ позыв на мочеиспускание сопровождается болью (от 1 до 10 баллов)_____,
□ позыв на мочеиспускание ощущается как давление внизу живота,
□ позыв на мочеиспускание ощущается как распирание внизу живота,
□ ощущение неполного опорожнения мочевого пузыря при наличии остаточной мочи,
□ ощущение неполного опорожнения мочевого пузыря при отсутствии остаточной мочи.
Симптомы нарушения сократительной активности детрузора:
□ удовлетворительная струя мочи,
□ вялая струя мочи,
□ императивное недержание мочи,
□ необходимость натуживания для инициации мочеиспускания,
□ необходимость натуживания для продолжения мочеиспускания,
□ необходимость натуживания для окончания мочеиспускания.
Симптомы нарушения сократительной активности гладкого сфинктера уретры:
□ невозможность самостоятельного мочеиспускания при наличии позыва на мочеиспускание,
□ прерывистое мочеиспускание, как правило, одинаковыми порциями,
□ отсроченное начало мочеиспускания.
Симптомы нарушения сократительной активности мышц тазового дна:
□ необходимость расслабления мышц тазового дна (промежности) для инициации мочеиспускания,
□ необходимость напряжения мышц тазового дна (промежности) для окончания мочеиспускания.
Поведенческие симптомы:
□ невозможность мочеиспускания в присутствии посторонних (в т.ч. медперсонала),
□ ограничение питьевого режима,
□ использование гигиенических средств (прокладок ______ шт./сут., памперсов),
□ контрольные мочеиспускания «на дорожку».
Симптомы НМП, связанные с положением тела больного (в пространстве):
□ невозможность точного попадания струи мочи в унитаз (для мужчин),
□ невозможность мочеиспускания в положении лежа,
□ невозможность мочеиспускания в положении стоя.
Установление четкой связи урологических симптомов с неврологическим заболеванием (временные факторы, сравнение клинических проявлений с данными параклинических исследований).
Для установления нейрогенной природы расстройства мочеиспускания необходимо несколько условий:
• наличие верифицированного неврологического заболевания;
• исключение психогенного расстройства мочеиспускания;
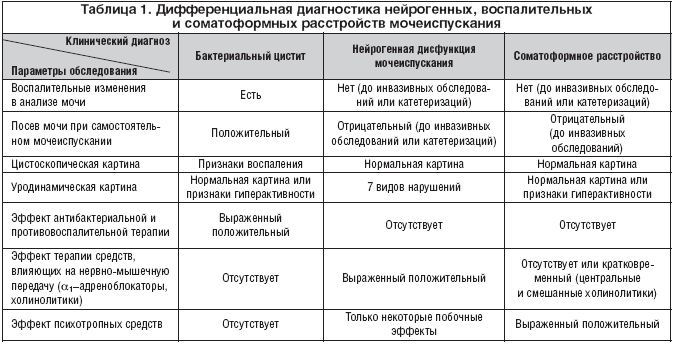
• соотношение во времени появления СНМП с двигательными, когнитивными, зрительными и др. неврологическими симптомами (табл. 1).
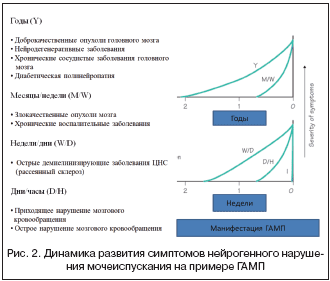
Анализ динамических показателей развития СНМП позволяет сопоставить их с основными неврологическими проявлениями болезни. Подобные сопоставления позволяют клиницисту выявить закономерность в развитии этих симптомов: например, постепенное развитие когнитивного дефицита и лобной апраксии ходьбы и переход поллакиурии в императивное недержание мочи при субкортикальной артериосклеротической энцефалопатии. Другим (обратным) примером может служить уменьшение проявлений гиперактивного мочевого пузыря (ГАМП) у больных, перенесших ишемический инсульт, в резидуальный период по сравнению с ранним восстановительным. На рисунке 2 графически изображены динамические показатели развития нейрогенных расстройств мочеиспускания при различных заболеваниях нервной системы на примере синдрома ГАМП.
Определение формы нарушения мочеиспускания. На следующем диагностическом этапе с помощью специальной уродинамической аппаратуры определяют форму нарушения мочеиспускания.
Сведения, полученные в ходе уродинамического исследования, помогают правильно оценить нарушения акта мочеиспускания, установить точный диагноз, определить показания и тактику лечения, обеспечив высокую степень успеха.
Уродинамические методы являются сложными с технической точки зрения и инвазивными с медицинской (опасность ятрогенного инфицирования НМП), поэтому вопрос о целесообразности их обязательного проведения дискутируется [2,5,8,9].
Урофлоуметрия – неинвазивный метод, позволяющий определить среднюю и максимальную скорость мочеиспускания (мл/сек.), степень инфравезикальной обструкции. Минусами метода является отсутствие информации о тонусе детрузора и уретры. Кроме того, для проведения исследования необходим объем мочеиспускания 200–300 мл, что невозможно у больных с ГАМП.
Цистометрия – малоинвазивный метод, позволяющий определить тонус детрузора в различные фазы наполнения мочевого пузыря по уродинамическому катетеру. Метод выявляет непроизвольные сокращения детрузора, но не позволяет оценить функциональное состояние уретры.
Профилометрия – метод, при использовании которого можно определить функциональное состояние замыкательного аппарата уретры в норме и при повышении абдоминального давления, достоверно диагностировать стрессовое недержание мочи и нестабильность уретры.
Комплексное уродинамическое исследование является наиболее информативным уродинамическим методом, позволяющим оценить сократительную активность детрузора (фаза наполнения – цистометрия, фаза опорожнения – «давление – поток») и сфинктерного аппарата уретры (урофлоуметрия + электромиография (ЭМГ) тазового дна).
При проведении комплексного исследования определяются 7 форм нарушения мочеиспускания:
1. Нейрогенная детрузорная гиперактивность (НДГ) характеризуется наличием непроизвольных сокращений детрузора, проявляющимся повышением детрузорного давления при цистометрии. Это моторная форма клинически характеризуется наличием ирритативной симптоматики, в том числе императивного недержания мочи. Наиболее часто НДГ встречается при поражении паравентрикулярных областей головного мозга и Варолиевого моста (инсульт, рассеянный склероз, болезнь Паркинсона).
2. Нейрогенная детрузорная гиперактивность в сочетании со сниженной сократительной способностью детрузора характеризуется наличием непроизвольных сокращений детрузора, сопровождающихся колебанием детрузорного давления более 5 см вод. ст., регистрируемых как в первой, так и во второй фазах наполнения в ходе цистометрии. Однако несмотря на выраженный позыв к акту мочеиспускания, в момент непроизвольного сокращения детрузора при мочеиспускании отмечалось снижение максимальной и средней скорости потока мочи за счет уменьшения сократительной способности детрузора. Клинически проявляется смешанной симптоматикой. Эта форма встречается при рассеянном склерозе и, по–видимому, связана с дискоординацией стволовых и подкорковых центров мочеиспускания.
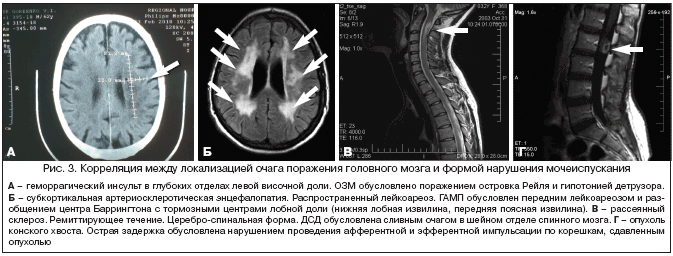
3. Нарушение сократительной способности детрузора характеризуется отсутствием повышения внутрипузырного давления при наполнении мочевого пузыря и снижением или отсутствием позыва на мочеиспускание. При мочеиспускании отмечается повышение внутрипузырного давления, в основном за счет повышения абдоминального давления. У больных с данной формой наиболее часто встречалась остаточная моча, выявляемая при УЗИ. Клинически проявляется обструктивными симптомами. Наиболее часто этот вид расстройства мочеиспускания отмечается у больных с височной и стволовой локализацией инсульта и при поражении поясничных и крестцовых сегментов спинного мозга, реже – при полинейропатиях (синдром Гийена– Барре, сахарный диабет).
4. Детрузорно–сфинктерная диссинергия (ДСД) характеризуется наличием непроизвольных сокращений детрузора при цистометрии. Непроизвольные сокращения детрузора регистрируются во все фазы наполнения мочевого пузыря как повышение детрузорного давления выше 5 см вод. ст. и в ряде случаев приводят к непроизвольным утечкам мочи. В то же время мочеиспускание из–за непроизвольных сокращений мышц тазового дна, регистрируемых на ЭМГ, отличается прерывистым характером. Наряду с ирритативными симптомами у больных с ДСД отмечаются симптомы обструкции (ощущение неполного опорожнения мочевого пузыря после мочеиспускания, прерывистое мочеиспускание, отсроченное начало мочеиспускания). Эта форма наиболее часто встречается при рассеянном склерозе, спинальном инсульте и поперечном миелите при наличии очагов поражения спинного мозга на уровне шейных и грудных сегментов.
5. Нарушение произвольного расслабления поперечно–полосатого сфинктера уретры (псевдодиссинергия) характеризуется равномерным повышением внутрипузырного давления в ходе цистометрии и достаточной цистометрической емкостью. Во время мочеиспускания у этих больных не отмечается «угасания» ЭМГ – активности мышц тазового дна, что, по всей видимости, является причиной снижения максимальной скорости потока мочи. Клинически проявляется отсроченным началом мочеиспускания. Наиболее часто встречается при нарушении стволово–мозжечковых связей (рассеянный склероз, болезнь Паркинсона, дисциркуляторная энцефалопатия) [12].
6. Гиперактивный мочевой пузырь без детрузорной гиперактивности характеризуется отсутствием непроизвольных сокращений детрузора при цистометрии в сочетании с уменьшением цистометрической емкости. Эта гиперсенсорная форма клинически сходна с НДГ и встречается при поражении лобных центров или нарушении проводящих путей, идущих от лобной доли (рассеянный склероз, инсульт, дисциркуляторная энцефалопатия), реже – при поражении периферических нервов (сахарный диабет).
7. Стрессовое недержание мочи выявляется в ходе профилометрии и характеризуется наличием утечек мочи при кашле, что регистрируется недостаточным смыканием шейки мочевого пузыря и внутреннего сфинктера уретры. Данная форма характерна для нейродегенеративных и ишемических процессов, происходящих в стволе мозга (синдром Шай–Драйжера, вертебрально–базилярная недостаточность).
Заболевания нервной системы отличаются не только по клиническим признакам нарушения мочеиспускания, но и по уродинамическим показателям.
Определение функциональных
и нейромедиаторных особенностей расстройства мочеиспускания
Вызванные потенциалы. Вызванные потенциалы различных модальностей могут косвенно подтвердить нейрогенную причину расстройств мочеиспускания. Зоны головного мозга, соответствующие 3–му и 4–му пикам акустических стволовых вызванных потенциалов, пролегают в непосредственной близости от центра Баррингтона. Признаки ишемического и демиелинизирующего поражения ствола мозга (снижение амплитуды импульсов и удлинение межпикового интервала) могут в ряде случаев объяснить возникновение позыва на мочеиспускание, вызванное шумом падающей воды (болезнь Паркинсона, дисциркуляторная энцефалопатия).
Соматосенсорные вызванные потенциалы со срамного нерва позволяют объективно оценить различные параметры чувствительности половых органов, выявить ассиметрию в проведении импульсов (постинсультную), определить локализацию (периферическую, спинальную или центральную) и демиелинизирующий или ишемический характер поражения нервных проводников мочевых путей. Таким образом, метод ССВП при стимуляции n. pudendus вносит существенный вклад в объяснение механизмов формирования нарушения мочевой (и половой) функций при различных неврологических заболеваниях.
Методы нейровизуализации (КТ и МРТ). Как уже неоднократно отмечалось, ведущая роль в функционировании НМП как в физиологических, так и патологических условиях принадлежит различным структурам головного и спинного мозга. Одни из них выполняют роль, исключительно связанную с регуляцией мочеиспускания (ядро Баррингтона, сторожевой центр мочеиспускания, ядро Онуфа–Онуфровича), другие отвечают за различные процессы организма, не связанные напрямую с мочеиспусканием (паравентрикулярное ядро гипоталамуса, островок Рейля, зрительные бугры). Однако повреждение последних также часто сопровождается СНМП, различных по характеру и степени выраженности.
Оценку сохранности функционально значимых зон головного и спинного мозга осуществляют при проведении магнитно–резонансной томографии (МРТ), компьютерной томографии (КТ). Сравнение характера и степени выраженности СНМП у больных, перенесших ишемический инсульт, с локализацией патологического процесса позволяет предположить патогенетические механизмы симптомов, а также объяснить различия в динамическом развитии (или регрессе) этих проявлений в остром, восстановительном (раннем и позднем) и резидуальном периодах инсульта. Полученные результаты позволят сделать предположение о пластичности отдельных структур, регулирующих мочеиспускание, а следовательно, и прогнозировать течение «урологических» осложнений инсульта и некоторых других заболеваний ЦНС. В качестве примера приводим несколько томограмм с кратким описанием клинической картины (рис. 3).
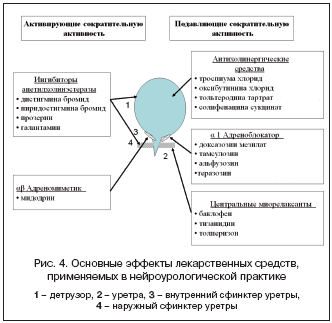
Фармакологический анализ. Определив форму нарушения мочеиспускания и установив связь с заболеванием нервной системы, т.е. установив диагноз «нейрогенный мочевой пузырь», клиницист назначает специфическое лечение. В практике нейроуролога используются лекарственные средства, влияющие преимущественно на холинергические, адренергические и, значительно реже, на другие нейромедиаторные системы. На рисунке 4 представлены основные точки приложения действия современных лекарств, применяемых для лечения нейрогенных расстройств мочеиспускания [17,18,20].
Анализ результатов лечения является заключительным диагностическим этапом. Например, применение специфического периферического конкурентного антагониста мускариновых рецепторов 2–го и 3–го подтипов троспиума хлорида уменьшает степень выраженности симптомов ГАМП при болезни Паркинсона, одновременно купируя сиалорею и спастический запор, что указывает на то, что ведущим механизмом этих трех, на первый взгляд, независимых симптомов болезни Паркинсона является парасимпатикотония, развивающаяся, как правило, к 5–7 году от начала заболевания.
Заключение
Нейрогенные расстройства мочеиспускания являются характерным и распространенным проявлением большинства заболеваний нервной системы. Использование уродинамических исследований позволяет выделить до 7 самостоятельных форм расстройств мочеиспускания, требующих индивидуального подхода к лечению. Диагностика нейрогенных нарушений мочеиспускания основывается на сравнении результатов клинических (вопросники и дневник мочеиспусканий) и параклинических (нейрофизиологических, уродинамических и нейровизуализационных) методов, а также на анализе результатов лечения, что позволяет на основании полученных данных оценить тяжесть неврологического заболевания и осуществить прогноз его дальнейшего развития.
https://www.liveinternet.ru/users/bogdan63/post205348812/